Contendo Domvanalimab como tratamento de primeira linha para Cânceres Gastrointestinais Superiores. Dados preliminares do Braço A1 do estudo EDGE-Gastric de Fase 2 apresentaram resultados promissores de ORR e PFS de seis meses, independentemente de expressão PD-L1, Domvanalimab é um anti-TIGIT Fc-silencioso em Fase 3 para adenocarcinomas GI superiores e tem o potencial de ser o primeiro tratamento disponível para esse tipo de câncer.
A Gilead Sciences, Inc. (Nasdaq: GILD) e Arcus Biosciences, Inc. (NYSE: RCUS) anunciaram que domvanalimab em combinação com zimberelimab e quimioterapia demonstraram resultados promissores de taxa de resposta objetiva (ORR) e taxa de sobrevida livre de progressão (PFS) de seis meses em uma análise preliminar do Braço A1 do estudo EDGE-Gastric. Este estudo de fase 2, multibraço, global e em andamento está avaliando a segurança e eficácia de várias combinações do anticorpo Fc-silencioso anti-TIGIT domvanalimab mais o anticorpo anti-PD-1 zimberelimab e quimioterapia em pacientes com adenocarcinoma gástrico, junção gastroesofágica ou esofágico local avançado inoperável ou metastático. Estes resultados foram apresentados durante a série plenária mensal da Sociedade Americana de Oncologia Clínica (ASCO), um fórum virtual para apresentação e discussão das pesquisas mais recentes sobre o câncer.
—Os dados preliminares do estudo EDGE-Gastric ressaltam o papel potencial do regime duplo de anti-TIGIT e anti-PD-1 no tratamento do câncer gastroesofágico no qual a quimioterapia de primeira linha com bloqueio anti-PD-1 é atualmente o padrão —disse a Dra. Yelena Y. Janjigian, Médica chefe do Serviço de Oncologia Médica Gastrointestinal, Memorial Sloan Kettering Cancer Center, e investigadora principal do estudo EDGE-Gastric.
No corte de dados (04 de setembro de 2023), 41 pacientes foram randomizados e tratados com um acompanhamento médio de 8,1 meses; 24 pacientes (59%) permaneceram no tratamento do estudo no momento do corte de dados. O tempo mediano em tratamento foi de 33 semanas (variação: <1 a 53 semanas).
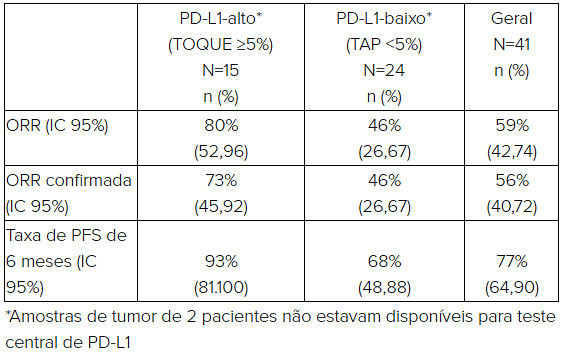
O regime contendo domvanalimab apresentou uma ORR de 80% em pacientes com tumores PD-L1-alto (positividade ativa do tumor (TAP) ≥5%), 46% em pacientes com tumores PD-L1-baixo (TAP <5%) e 59% para pacientes no geral. Houveram duas respostas completas confirmadas. Taxa de PFS histórica de seis meses foi de 93% para pacientes com tumores PD-L1-alto (TAP ≥5%), 68% para pacientes com tumores PD-L1-baixo (TAP <5%) e 77% para pacientes no geral. PFS mediana não foi alcançada e dados consolidados de PFS são esperados para a segunda metade do próximo ano.
Os resultados de eficácia incluindo taxas de ORR e PFS de seis meses são resumidos na tabela abaixo:
IC: intervalo de confiança —O regime contendo domvanalimab foi bem tolerado, com um perfil de segurança similar ao que foi relatado para PD-1 mais quimioterapia neste cenário. Os eventos adversos (EAs) mais comuns foram neutropenia (59%), náusea (54%), anemia (27%) e fadiga (27%). Reações relacionadas a infusão foram observadas em 20% e a maioria (17%) foi relacionada à quimioterapia. Nenhum paciente vivenciou EAs imunomediados graves, e não houve eventos adversos emergentes do tratamento (TEAEs) resultando em morte.
Estes dados contribuem para o crescente corpo de evidência que domvanalimab, um anticorpo Fc-silencioso anti-TIGIT, tem perfil de segurança e tolerabilidade diferenciado com relação aos dados publicados de estudos com anticorpos FC-habilitado anti-TIGIT.
Os dados preliminares do Braço A1 do estudo EDGE-Gastric de Fase 2 corroboram o estudo de Fase 3 em andamento, STAR-221, em cânceres gastrointestinais superiores inoperáveis ou metastáticos. As empresas têm três estudos de registro de fase 3 adicionais e em andamento contendo contendo domvanalimab em câncer de pulmão, incluindo STAR-121, ARC-10 e PACIFIC-8.
Domvanalimab e zimberelimab são moléculas em investigação. Nem a Gilead ou a Arcus recebeu aprovação de qualquer autoridade regulatória para qualquer uso global, e sua segurança e eficácia para o tratamento de cânceres gastrointestinais e de pulmão não foi estabelecida.
Estudo EDGE-Gastric — O estudo em andamento, multibraço, global, EDGE-Gastric (NCT05329766) está avaliando a segurança e eficácia de várias combinações do anticorpo Fc-silencioso anti-TIGIT domvanalimab e o anticorpo anti-PD-1 zimberelimab em pacientes com adenocarcinoma gástrico (G), de junção gastroesofágica (GEJ) ou esofágico (E) local avançado inoperável ou metastático. Pacientes no Braço A1, com adenocarcinoma G/GEJ/E previamente não tratado, receberam 1600 mg de domvanalimab por via intravenosa (IV) uma vez a cada quatro semanas (Q4w) mais 480 mg de zimberelimab IV Q4W + Folfox (oxaliplatin 85 mg/m2 IV, leucovorin 400 mg/m2 IV, fluorouracil 400 mg/m2 IV bolo + 2400 mg/m2 infusão IV contínua 46-48-horas) a cada duas semanas.
Domvanalimab — Domvanalimab é um anticorpo monoclonal Fc-silencioso em investigação em estudos pivotais que é desenvolvido para bloquear e vincular ao imunoreceptor de célula T com domínios Ig e ITIM (TIGIT), um receptor de proteína em células imunes que atua como um freio na resposta imunológica. As células cancerígenas podem explorar o TIGIT para evitar detecção pelo sistema imunológico. Ao vincular-se ao TIGIT, espera-se que o domvanalimab libere os caminhos de ativação imune e ative as células imunes para atacar e matar as células cancerígenas. Domvanalimab demonstrou cobertura de receptor completa em todos os leucócitos periféricos expressando TIGIT.
Domvanalimab está sendo avaliado em quatro estudos de registo de fase 3 de cânceres de pulmão e gastrointestinais, incluindo: (1) ARC-10, avaliando domvanalimab em combinação com zimberelimab versus pembrolizumab em NSCLC de primeira linha localmente avançado ou metastático PD-L1 ≥50% ; (2) PACIFIC8, sendo operacionalizado pela AstraZeneca, avaliando domvanalimab em combinação com durvalumab em NSCLC inoperável de estágio 3; (3) STAR-121, avaliando domvanalimab em combinação com zimberelimab e quimioterapia versus pembrolizumab em combinação com quimioterapia em NSCLC de primeira linha PD-L1- não selecionado; e (4) STAR-221, avaliando domvanalimab em combinação zimberelimab e quimioterapia versus nivolumab em combinação com quimioterapia em adenocarcinomas gástricos, esofágicos ou de junção gastroesofágica de primeira linha, local, avançado inoperável ou metastático.
Arcus Biosciences — A Arcus Biosciences é uma empresa biofarmacêutica global de estágio clínico que desenvolve moléculas diferenciadas e medicamentos combinados para pessoas com câncer. Em parceria com outras empresas, pacientes e médicos ao redor do mundo, a Arcus está acelerando o desenvolvimento de medicamentos first in class, ou best in class, contra alvos e caminhos biológicos bem caracterizados e estudando combinações novas e direcionadas pela biologia que tem o potencial de ajudar pessoas com câncer a viverem mais. Fundada em 2015, a empresa tem acelerado o desenvolvimento de múltiplos medicamentos investigacionais em estudos clínicos, incluindo novas abordagens de combinações que tem como alvo TIGIT, PD-1, o eixo adenosina (CD73 e receptor dual A2a/A2b) e HIF-2a. Para mais informações sobre os programas clínicos e pré-clínicos da Arcus Biosciences, acesse o site.
A Gilead Sciences — Gilead Sciences, Inc. é uma empresa biofarmacêutica que tem buscado e atingido avanços na medicina há mais de três décadas, com a meta de criar um mundo mais saudável para todas as pessoas. A empresa está comprometida com o avanço de medicamentos inovadores para prevenir e tratar doenças de ameaça à vida, incluindo HIV, hepatite viral, covid-19 e câncer. A Gilead opera em mais de 35 países em todo o mundo, com sede em Foster City, Califórnia.